سبد خرید
0
هیچ محصولی در سبد خرید نیست.
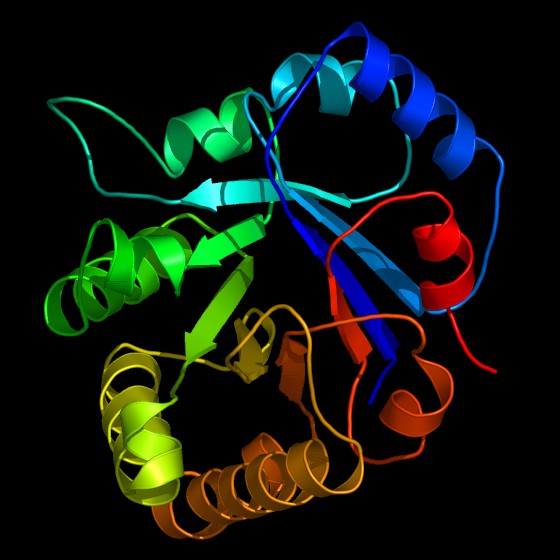
آنزیمها برای حفظ حیات ضروری هستند؛ زیرا اکثر واکنشهای شیمیایی در سلولهای بیولوژیکی مانند هضم غذا، خیلی آرام اتفاق میافتند یا منجر به محصولات مختلفی بدون فعالیت آنزیمها میگردند. اکثر بیماریهای ارثی نتیجهی یک جهش ژنتیکی، تولید بیش از حد یا کمبود یک آنزیم حساس هستند. برای مثال، «عدم تحمل لاکتوز یا نارسایی لاکتاز» (lactose intolerance) که به معنای عدم توانایی هضم مقادیر قابل توجه لاکتوز که قند اصلی در شیر است، ناشی از کمبود آنزیم لاکتاز است. یک آنزیم برای اینکه کاربردی باشد، باید به یک شکل سه بعدی دقیق تبدیل گردد. این که چطور چنین ساختار پیچیدهای شکل میگیرد، هنوز به شکل راز باقی مانده است.یک زنجیرهی کوچک از 150 آمینواسید یک آنزیم را شکل میدهد که تعداد بسیار زیادی پیکربندی مختلف دارد: اگر 1012 پیکربندی مختلف در هر ثانیه آزمایش گردند، حدود 1026 سال برای یافتن و درک یک مدل زمان مورد نیاز است.
با این حال یک آنزیم «دناتوره شده یا واسرشته» (denatured) میتواند در کسری از ثانیه تغییر شکل و سپس به طور دقیق در یک واکنش شیمیایی واکنش نشان دهد. برخی دانشمندان تصور میکنند، اثرات «کوانتومی» (quantum) حتی در فواصل بزرگ (با استانداردهای اتمی) که توسط یک مولکول پروتئین ظهور میکند، منجر به ایجاد رفتارهای اینچنینی میگردد. این آنزیمها نوعی پیچیدگی مبهوتکننده و توازن یا هارمونی را در جهان اثبات میکنند.در حالی که تمام آنزیمها نقش بیولوژیکی دارند، بعضی از آنها به صورت تجاری مورد استفاده قرار میگیرند. به عنوان مثال، بسیاری از پاککنندههای خانگی از آنزیمها برای افزایش سرعت تجزیهی لکههای پروتئین یا نشاسته روی لباسها استفاده میکنند.
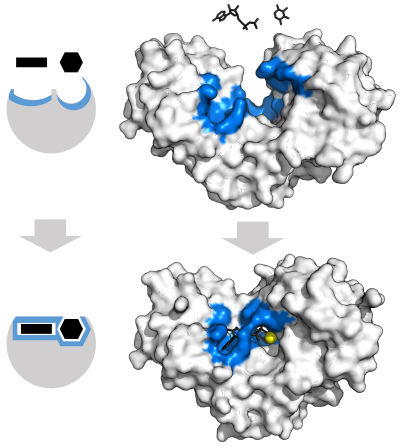
مانند تمام کاتالیستها، آنزیمها هم برای کاهش انرژی فعالسازی یک واکنش یا انرژی ابتدایی لازم برای رخ دادن اکثر واکنشهای شیمیایی به کار میروند. گرما را نمیتوان به یک سیستم زنده اضافه کرد، بنابراین آنزیمها یک مسیر جایگزین را فراهم میکنند: آنها با یک زیرلایه (مواد موجود در واکنش شیمیایی) برای تشکیل یک «حالت گذار» (transition state)، یک «کمپلکس واسطهی ناپایدار» (unstable intermediate complex) که نیاز به انرژی کمتری برای پیشروی واکنش دارد، پیوند میدهند.
ساختار آنزیم مهم است، زیرا عملکرد خاص آنزیم در بدن را تعیین میکند. آنزیمها (و سایر پروتئینها) از زنجیرههای اسید آمینه به نام زنجیرههای «پلیپپتیدی» (polypeptide) تشکیل شدهاند. دنبالهی خطی آمینواسیدها تعیینکنندهی مشخصات تاشدگی زنجیرهها به یک ساختار سه بعدی است. یک آنزیم ممکن است فقط یک زنجیرهی پلیپپتیدی داشته باشد که معمولا یک صد آمینواسید یا تعداد بیشتری را به هم پیوند میدهد یا ممکن است شامل چندین زنجیرهی پلیپپتیدی باشد که با هم به عنوان یک واحد عمل میکنند. اکثر آنزیمها بزرگتر از زیرلایههایی هستند که روی آن عمل میکنند. فقط یک قسمت خیلی کوچک از آنزیم، تقریبا 10 آمینواسید، دارای تماس مستقیم با زیرلایهها است. این ناحیه، جایی که پیوند بین زیرلایهها و واکنش اتفاق میافتد، به عنوان سایت فعال آنزیم شناخته میشود.

همانند یک کاتالیست، آنزیم طی واکنش تکمیل شده بدون تغییر باقی میماند؛ بنابراین میتواند به فعل و انفعال با زیرلایهها ادامه دهد. آنزیمها ممکن است طی فرایندی به خصوص سرعت واکنشها را تا چندین میلیون برابر افزایش دهند. آنزیمها میتوانند توسط مولکولهایی که فعالیت آن را افزایش میدهد، «راهانداز» (activator)، یا مولکولهایی که باعث کاهش فعالیت آنها میگردد، «مهارکننده» (inhibitor) تحت تاثیر قرار گیرند. بسیاری از داروها با مهار آنزیمها در بدن عمل میکنند و اثر خود را نشان میدهند. «آسپیرین» (aspirin) از طریق مهار آنزیمهای «COX-1» و «COX-2» کار میکند. آنزیمهایی که «پروستاگلاندین» (prostaglandin) تولید میکنند، یک پیامرسان هورمونی برای نشان دادن التهاب به شمار میروند. با مهار فعالیت این آنزیمها، «آسپیرین» (aspirin) تجربهی ما از درد و التهاب را سرکوب میکند.
بیشتر بخوانید >>>>>>>>>>>>چگونه از آلودگی درکشت سلول جلوگیری کنیم؟
یکی از فرآیندهای مربوط به پروتئین ها دناتوره (Denature) شدن آن هاست. تغییر شکل پروتئین بر اثر تغییر عوامل محیطی چون PH، دما و غیره دا واسرشتن یا دناتوره شدن میگویند. طی دناتوراسیون ساختمان طبیعی سه بعدی پروتئینی (Native) از بین می رود و دیگر پروتئین قادر به انجام عملش نخواهد بود. برخی پروتئین ها می توانند بعد از برداشتن عامل دناتوره کننده دوباره به حالت طبیعی برگردند که به این فرآیند رناتوراسیون می گویند. در این جریان پیوند های پپتیدی بدون تغییر باقی می مانند بنابراین ساختمان نوع اول بدون تغییر حفظ می شود. این عمل بین 55-85 درجه انجام می شود. کازئین به علت وجود اسید آمینه سیستئین در دمای بسیار بالا دناتوره می شود. علت مقاومت حرارتی کازئین و ژلاتین وجود اسید آمینه پرولین در ساختمان آنها است. فاکتورهای دناتوره کننده مانند اوره و گوانیدین هیدروکلراید، پروتئین را به یک حالت random coil در میآورد و حذف این عوامل از ماکرومولکول با تغییر فرم آن به حالت طبیعی همراه است. روش های زیادی برای برگرداندن پروتئین به حالت طبیعی مورد مطالعه قرار گرفته است. نتایج موفقیت آمیزی برروی پروتئین آسپارتات ترانسکربوکسیلاز انجام شد.
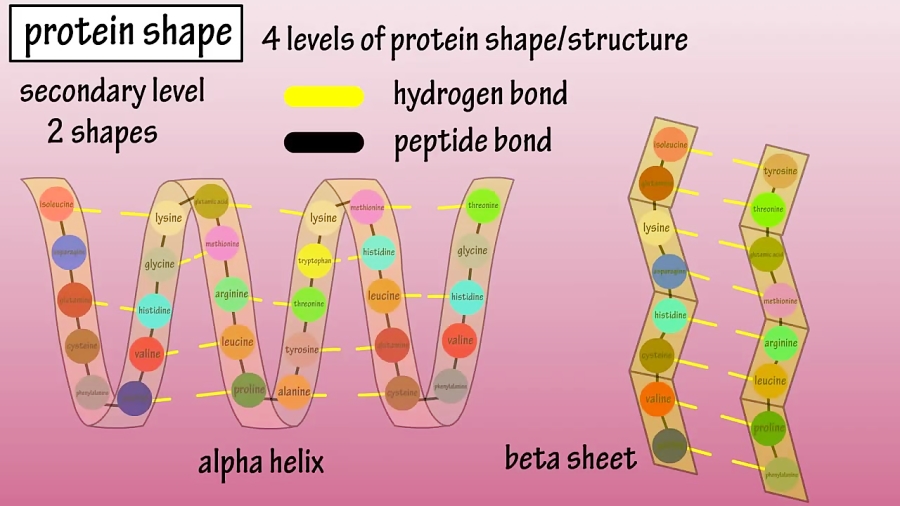
کاهش حلالیت، کاهش فعالیت بیولوژیکی، حساسیت بیشتر در مقابل آنزیم های تجزیه کننده پروتئین و تغییر قدرت جذب آب می باشد. دو اسید آمینه مهم و موثر در دناتوراسیون: 1- سیستئین: افزایش آن با عث انجام واکنشهایی که منجر به تشکیل پیوند های دی سولفیدی بین رشته های پروتئیین می شود که منجر به تجمع مولکولهای پروتئین و رسوب آنها و افزایش دناتوراسیون می شوند. 2- پرولین: افزایش آن مانع تشکیل ساختمان فضایی درپروتئین می شود و باعث عدم وجود خواصی که بوسیله دناتوره تغییر می کند باشد وباعث افزایش مقاومت حرارتی پروتئین و در نتیجه غیر قابل دناتوره می شود. مانند کازئین و ژلاتین پروتئیین دناتوره تحت شرایط زیر امکان برگشت به حالت طبیعی برگردند: 1-تحت شرایط قوی و شدید دناتوره نشده باشند. 2- حذف ماده دناتوره کننده. در صورت که شکل قویوبا شدت عوامل دناتوره استفاده شود حتی باعث تجزیهساختمان اول می شوند مانند حرارت بالا و اسید قوی. انجام عمل دناتوره در محدوده حرارتی کم با سرعت زیاد انجام می شود که بیانگر ماهیت تسهیل شوندگی این شرایط است.
یک واکنش کاتالیز شده توسط آنزیمها باید به صورت خود به خودی باشد. بدین معنا که با میل طبیعی بدون نیاز به فشار خارجی صورت پذیرد (از دید ترمودینامیکی، واکنش باید دارای یک انرژی خالص منفی گیبس باشد). به عبارت دیگر، واکنش بدون آنزیم در جهت یکسان با حالت آنزیمدار صورت میگیرد. منتها در حالت بدون آنزیم، واکنش به میزان قابل توجهی کندتر اتفاق میافتد. به عنوان مثال، تجزیهی ذرات مواد غذایی مانند «کربوهیدراتها» (carbohydrates) به اجزای کوچکتر قند به صورت خود به خودی صورت میگیرد، اما افزودن آنزیمها همانند «آمیلازها» (amylases) در بزاق ما باعث میشود واکنش سریعتر رخ دهد.
آنزیمها میتوانند دو یا چند واکنش را با هم جفت کنند، به طوری که یک واکنش خود به خودی میتواند برای انجام یک واکنش نامطلوب مورد استفاده قرار گیرد. به عنوان مثال، با آزادسازی ترکیب انرژی بالا «آدنوزین تری فسفات» (Adenosine triphosphate, ATP) انرژی واکنشهای شیمیایی نامطلوب مانند ساخت پروتئینها فراهم میگردد.
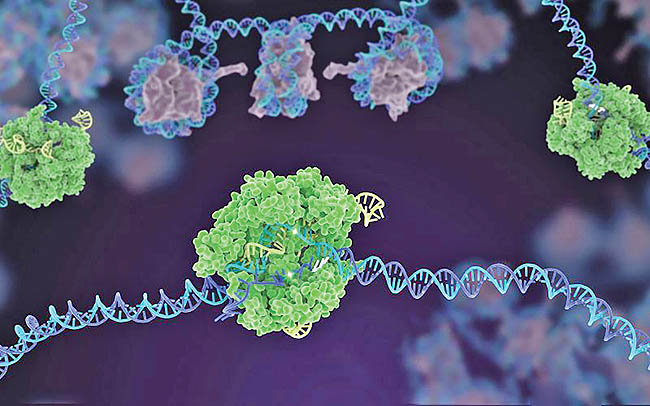
به طور کلی همانند یک کاتالیست، آنزیم طی واکنش تکمیل شده بدون تغییر باقی میماند؛ بنابراین میتواند به فعل و انفعال با زیرلایهها ادامه دهد. آنزیمها ممکن است طی فرایندی به خصوص سرعت واکنشها را تا چندین میلیون برابر افزایش دهند. آنزیمها میتوانند توسط مولکولهایی که فعالیت آن را افزایش میدهد، «راهانداز» (activator)، یا مولکولهایی که باعث کاهش فعالیت آنها میگردد، «مهارکننده» (inhibitor) تحت تاثیر قرار گیرند. با این حال یک آنزیم«دناتوره شده یا واسرشته» (denatured) میتواند در کسری از ثانیه تغییر شکل و سپس به طور دقیق در یک واکنش شیمیایی واکنش نشان دهد.
برای خرید مواد آزمایشگاهی شیمیایی و صنعتی و یا خرید تجهیزات آزمایشگاهی شما میتوانید با مراجعه به فروشگاه شرکت آثل طب از خدمات آزمایشگاهی برخوردار شوید.